9月21日—9月27日醫(yī)藥行業(yè)的這些動(dòng)態(tài)值得關(guān)注
封面新聞
國家藥監(jiān)局發(fā)布公告�,決定成立第十二屆藥典委員會(huì)�。本屆藥典委員會(huì)由454名委員組成,設(shè)執(zhí)行委員會(huì)和29個(gè)專業(yè)委員會(huì)���,國家藥監(jiān)局局長焦紅任主任委員��,2025年版《中國藥典》編制工作全面啟動(dòng)�。
行業(yè) · 政策動(dòng)態(tài)
1.國家藥監(jiān)局發(fā)布仿制藥參比制劑目錄(第五十九批)�����,涉及異麥芽糖酐鐵注射液等藥品�����。
2.國家中醫(yī)藥管理局辦公室���、國家藥監(jiān)局綜合和規(guī)劃財(cái)務(wù)司聯(lián)合印發(fā)《古代經(jīng)典名方關(guān)鍵信息表(25首方劑)》��。此次發(fā)布的25首方劑包括桃核承氣湯���、芍藥甘草湯、半夏瀉心湯等����?�!缎畔⒈怼泛w每首方劑出處���、處方、制法及用法����、藥味名稱、基原及用藥部位��、炮制規(guī)格��、折算劑量�����、用法用量���、功能主治等信息。
3.國家藥監(jiān)局藥品審評中心就《基于人用經(jīng)驗(yàn)的中藥復(fù)方制劑新藥藥學(xué)研究技術(shù)指導(dǎo)原則(征求意見稿)》征求意見����?���!墩髑笠庖姼濉窂?qiáng)調(diào)了人用經(jīng)驗(yàn)藥學(xué)研究應(yīng)基于中醫(yī)臨床實(shí)踐���,明確人用經(jīng)驗(yàn)所用藥物的藥學(xué)關(guān)鍵信息����,中藥復(fù)方制劑新藥的質(zhì)量應(yīng)與人用經(jīng)驗(yàn)所用藥物的質(zhì)量基本一致��,人用經(jīng)驗(yàn)藥學(xué)關(guān)鍵信息應(yīng)可溯源����。并明確了處方、制備工藝�、劑型、質(zhì)量研究及質(zhì)量標(biāo)準(zhǔn)��、穩(wěn)定性和橋接研究等具體要求����。征求意見截止日期為2022年10月26日。
4.國家藥監(jiān)局藥品審評中心就《咀嚼片(化學(xué)藥品)質(zhì)量屬性研究技術(shù)指導(dǎo)原則(征求意見稿)》公開征求意見�����。《征求意見稿》適用于屬于常釋制劑(化學(xué)藥品)的咀嚼片或說明書用法項(xiàng)下注明可咀嚼后服用片劑的研究和開發(fā)�。征求意見截止日期為2022年10月25日。
5.國家藥監(jiān)局藥品審評中心就《治療卵巢癌新藥臨床研發(fā)技術(shù)指導(dǎo)原則(征求意見稿)》公開征求意見�。《征求意見稿》從新藥臨床開發(fā)的探索性階段和確證性階段介紹了方案設(shè)計(jì)需關(guān)注的重點(diǎn)問題���,對治療卵巢癌新藥臨床研發(fā)的技術(shù)考慮要點(diǎn)進(jìn)行了詳細(xì)闡述���。征求意見截止日期為2022年10月25日。
6.國家藥監(jiān)局藥品審評中心就《中藥新藥臨床試驗(yàn)用藥品的制備研究技術(shù)指導(dǎo)原則(征求意見稿)》公開征求意見��?!墩髑笠庖姼濉窂?qiáng)調(diào)中藥新藥臨床試驗(yàn)用藥品應(yīng)符合相關(guān)質(zhì)量管理規(guī)范要求,保證試驗(yàn)藥物質(zhì)量�����,滿足中藥新藥臨床試驗(yàn)需要�。并對試驗(yàn)藥物和安慰劑的制備��、質(zhì)量控制要求以及包裝���、貯藏等方面明確了具體要求�。征求意見截止日期為2022年10月26日。
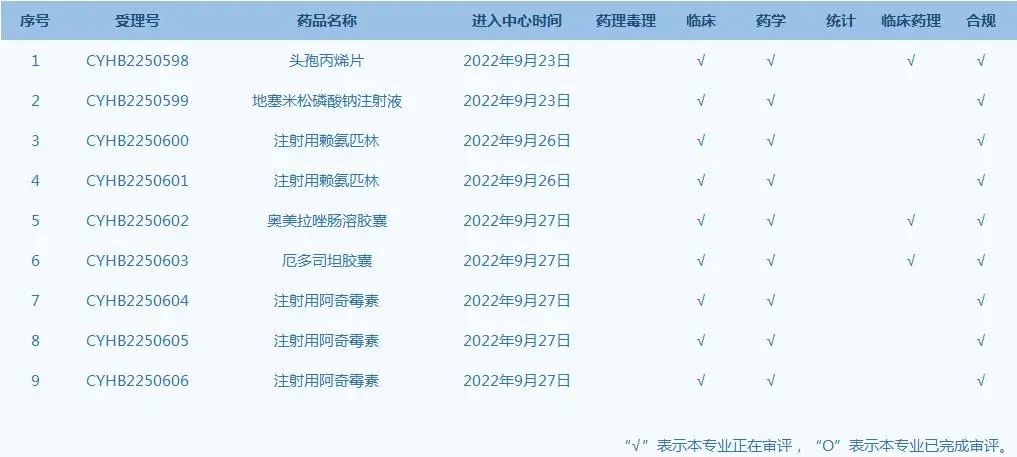
7.國家藥監(jiān)局藥品審評中心網(wǎng)站公示9個(gè)仿制藥一致性評價(jià)任務(wù)�����,涉及頭孢丙烯片等藥品(截至9月27日)��。
產(chǎn)品研發(fā) · 上市信息
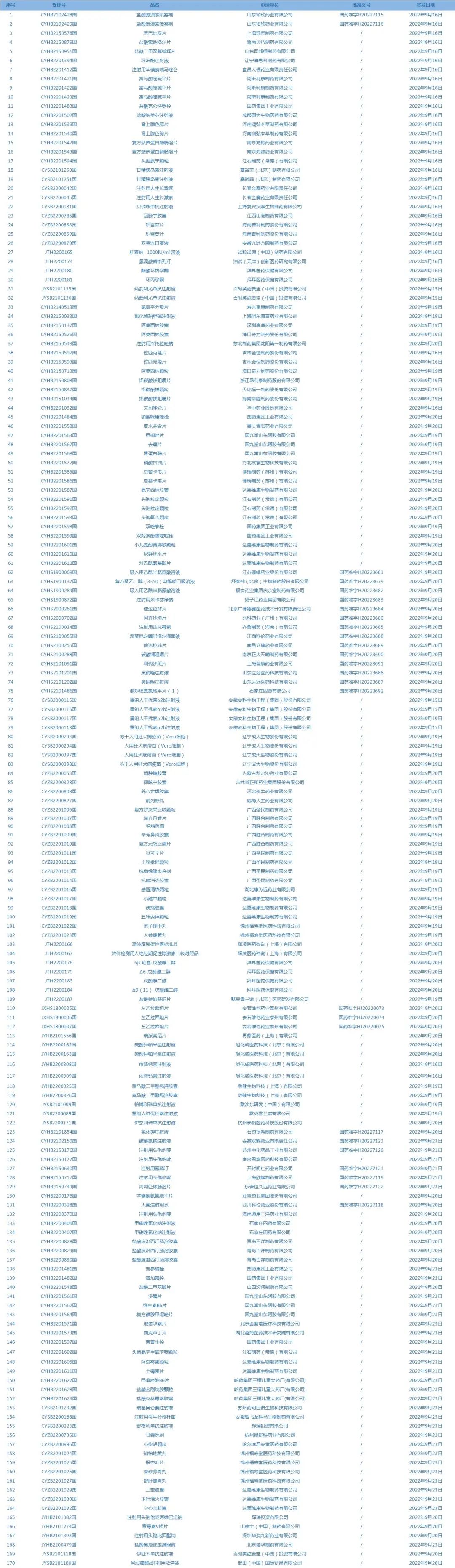
1.國家藥監(jiān)局發(fā)布3期藥品批準(zhǔn)證明文件待領(lǐng)信息���,共包括170個(gè)受理號�����,涉及阿斯利康制藥有限公司等企業(yè)(截至9月27日)���。
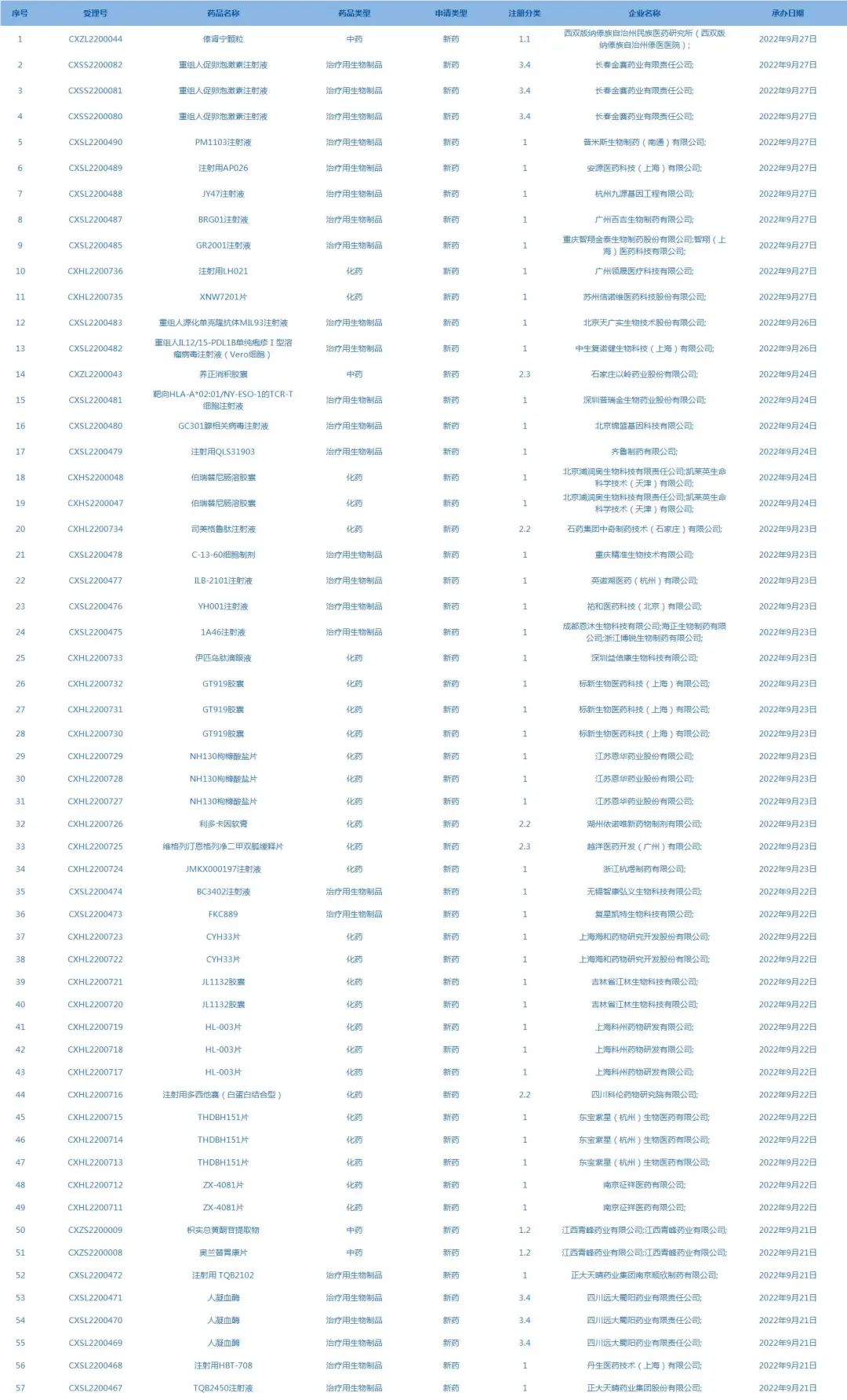
2.國家藥監(jiān)局藥品審評中心承辦受理57個(gè)新藥上市申請,包括傣腎寧顆粒等藥品(截至9月27日)�。
3.華海藥業(yè)發(fā)布公告稱,收到美國食品藥品管理局(FDA)的通知����,公司向FDA申報(bào)的奈必洛爾纈沙坦片的新藥簡略申請獲得批準(zhǔn)。
4.普利制藥發(fā)布公告稱���,收到新加坡衛(wèi)生科學(xué)局(HSA)簽發(fā)的注射用阿奇霉素批準(zhǔn)通知�。
醫(yī)藥企業(yè)觀察
1.羅欣藥業(yè)發(fā)布公告稱,公司與上藥控股有限公司就建立醫(yī)藥市場戰(zhàn)略性伙伴關(guān)系事宜����,達(dá)成戰(zhàn)略合作伙伴框架協(xié)議。
2.千紅制藥與湖北省鐘祥市人民政府簽訂《常州千紅制藥原料藥生產(chǎn)基地項(xiàng)目合同書》�����,千紅制藥擬使用自有資金投資6億元在湖北省鐘祥市新建原料藥生產(chǎn)基地項(xiàng)目�����。
3.雙成藥業(yè)與Meitheal Pharmaceuticals, Inc.(以下簡稱“Meitheal”)和Hong Kong King-Friend Industrial Co., Ltd.(以下簡稱“HKF”)簽署《許可及供應(yīng)協(xié)議》��。協(xié)議約定��,雙成藥業(yè)將研發(fā)和生產(chǎn)的制劑注射用紫杉醇(白蛋白結(jié)合型�����,100mg/瓶)在美國地區(qū)內(nèi)的獨(dú)家許可授予Meitheal和HKF�。Meitheal負(fù)責(zé)該產(chǎn)品在美國地區(qū)內(nèi)的市場規(guī)劃及銷售,產(chǎn)品上市后��,Meitheal應(yīng)向雙成藥業(yè)支付美國地區(qū)內(nèi)產(chǎn)品銷售產(chǎn)生的利潤分成�����;HKF需向雙成藥業(yè)支付一定的一次性里程碑款項(xiàng)���,總額為600萬美元�����。
4.百誠醫(yī)藥發(fā)布公告�,其全資子公司賽默制藥擬以5億元投資創(chuàng)新藥物�����、高端復(fù)雜制劑����、醫(yī)美(健康)產(chǎn)品CMO/CDMO(合同生產(chǎn)/商業(yè)生產(chǎn)外包)及研發(fā)中心項(xiàng)目,建設(shè)周期為24個(gè)月�����。
5.恒瑞醫(yī)藥發(fā)布公告稱�,公司全資子公司上海瑞宏迪擬通過增資擴(kuò)股方式引入恒瑞集團(tuán)、盛迪基金、迎泰資產(chǎn)管理作為新股東����,增資金額合計(jì)4.98億元。
6.諾誠健華于9月21日在上海證券交易所科創(chuàng)板上市��,發(fā)行價(jià)格為11.03元/股�����,開盤即破發(fā)���,報(bào)10.70元/股�。截至收盤��,諾誠健華報(bào)9.33元/股�,下跌15.41%,振幅18.04%����,成交額10.82億元。
7.四環(huán)醫(yī)藥宣布���,旗下非全資附屬公司惠升生物已完成以增資方式進(jìn)行的首輪融資����,投資人包括國壽大健康基金、天津遠(yuǎn)翼永宣��、天津遠(yuǎn)翼吉茂���、銀杏資本。根據(jù)本次增資協(xié)議���,上述四位投資方以5億元人民幣認(rèn)購惠升生物新發(fā)行的3333.3萬股的股份�,共占惠升生物的股權(quán)比例為10%�����。
8.9月26日�����,健康元藥業(yè)集團(tuán)股份有限公司發(fā)行的全球存托憑證(GDR)在瑞士證券交易所成功上市�,成為國內(nèi)首家赴瑞發(fā)行GDR并成功上市的生物醫(yī)藥企業(yè)。
藥品集中采購
1.云南省政府采購和出讓中心發(fā)布《2022年云南省生物制品(生物類似物)藥品掛網(wǎng)交易有關(guān)事宜的通知》��。經(jīng)審核通過的新生物制品(生物類似物)�,將于2022年10月17日起在云南省藥品集中采購平臺藥品交易系統(tǒng)正式啟用���,涉及167個(gè)生物制品。通知明確����,企業(yè)申報(bào)價(jià)格不高于省級采購平臺全國最低實(shí)際采購價(jià),且申報(bào)了全國最低3個(gè)省份中標(biāo)(掛網(wǎng))價(jià)格的藥品���,醫(yī)療機(jī)構(gòu)可按掛網(wǎng)價(jià)直接采購����,也可議價(jià)采購���;無省級采購平臺全國最低實(shí)際采購價(jià)或企業(yè)申報(bào)省級采購平臺招標(biāo)(掛網(wǎng))價(jià)格不足3個(gè)省份的�,議價(jià)采購�。
2.福建省藥械聯(lián)合采購中心發(fā)布《福建省藥品集中帶量采購文件》和《關(guān)于開展福建省第三批藥品集中帶量采購相關(guān)藥品信息填報(bào)工作的通知》,福建省正式開啟第三批藥品集采����。本次集采涉及50個(gè)產(chǎn)品,其中包括地衣芽孢桿菌活菌���、雙歧桿菌三聯(lián)活菌�����、重組人凝血因子 Ⅷ�、重組人生長激素4個(gè)生物制劑。
3.河北省醫(yī)保局發(fā)布《關(guān)于做好中藥配方顆粒掛網(wǎng)采購和醫(yī)保支付工作的通知》���。通知明確,將與中藥飲片對應(yīng)的中藥配方顆粒納入河北省醫(yī)保支付范圍����,按照乙類管理,個(gè)人先行自付比例全省統(tǒng)一確定為5%�。定點(diǎn)醫(yī)療機(jī)構(gòu)以最低掛網(wǎng)價(jià)格購進(jìn),可順加15%銷售��。納入醫(yī)保支付范圍的中藥配方顆粒����,按同一名稱管理,不區(qū)分生產(chǎn)企業(yè)���。自2022年11月1日起執(zhí)行����。
文章來源:中國食品藥品網(wǎng)


 宣上醫(yī)
宣上醫(yī)